製造工程での無菌性不良によるコスト(海外事例)
1万 ~100 万ドル
無菌性不良を解決するために見込まれるコスト
PDA(Parenteral Drug Association)が ISPE と共同でベンチマーク調査を実施したところ、製薬会社が実施する検査が失敗した場合、1万 ~100 万ドルのコストがかかる可能性があると推定されました。
Macher J. Business case for quality. Presented at the Pharmaceutical Quality System (ICH Q10) Conference, Arlington, VA, October 4-6, 2011. Accessed November 9, 2020. https://www.fda.gov/media/82992/download.
1 億 7500 万ドルの罰金
不適切な微生物汚染管理に見込まれる対価
ウイルスによるバイオリアクターの汚染が判明したある医薬品製造会社は、米国食品医薬品局から 1 億 7500 万ドルの罰金を科され、2009 年にマサチューセッツ州の工場の一時閉鎖を余儀なくされました。
Petrochko C. Gene drugmaker hit with heavy fines. MedPageToday. May 25, 2010. Accessed July 7, 2020. https://www.medpagetoday.com/publichealth policy/fdageneral/20290.
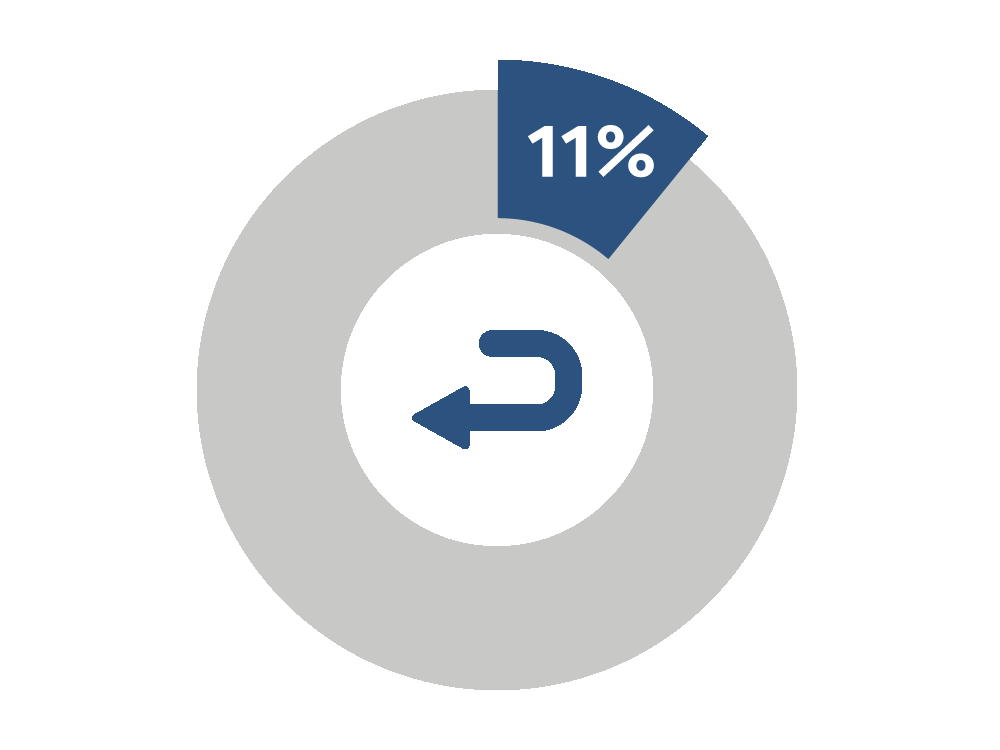
11 % のリコール
微生物汚染による無菌製品のリコールの割合
2004~2011 年の微生物学的管理に関連する 642 件のリコール分析により、80 % が無菌製品に関するもので、そのような無菌製品の 11 % が微生物汚染によりリコールされたことがわかりました。
Sutton S, Jimenez L. A review of reported recalls involving microbiological control 2004-2011 with emphasis on FDA considerations of “objectionable organisms.” Am Pharm Rev. 2012;15(1):42-57.
無菌接合装置 SCD IIBの適合チューブ
ポリ塩化ビニル(PVC)製チューブ:*
外径: 5.46 mm(0.215 in)
肉厚: 0.84 mm(0.033 in)
C-Flex チューブ:
外径: 6.35 mm(0.25 in)
内径: 3.18 mm(0.125 in)
*警告:上記に記載のある種類とサイズのチューブについては、テルモBCTによって接合強度と無菌性について試験済みです。その他の指定以外のチューブを使用する場合には、お客様の責任で、目的に該当する企画に従って接合強度と無菌性を試験してください。指定以外のチューブを使用した場合、接合部の強度が低くなり、無菌性不良を生じる恐れがあります。
本品は医療機器ではありません。
C-Flex is either a registered trademark or trademark of SAINT-GOBAIN PERFORMANCE PLASTICS CORPORATION in the United States and/or other countries.